細胞の“利き手”を決定する新原理を発見
理化学研究所(理研)生命機能科学研究センター フィジカルバイオロジー研究チームの山本 尚貴 研究員(研究当時)、石橋 朋樹 基礎科学特別研究員、柴田 達夫 チームディレクター、分子細胞動態研究チーム(研究当時)の清末 優子 チームリーダー(研究当時)、高次構造形成研究チーム(研究当時)の竹市 雅俊 チームリーダー(研究当時)らの研究グループは、体や器官の左右非対称性の基盤にあると考えられる、細胞の"利き手"ともいえる細胞キラリティ[1]を制御する新しい原理を、実験と理論を組み合わせたアプローチにより発見しました。
本研究成果は、生物の左右非対称な形づくりを駆動するメカニズムの解明への手がかりとなることが期待されます。
ヒトのようなほぼ左右対称な生物であっても、例えば、内臓の形態や位置に左右非対称な特徴が多く見られます。このような形の左右非対称性の成立過程では、細胞スケールのキラリティや、タンパク質など分子スケールのキラリティが関与していると考えられていますが、その詳細なメカニズムの理解は十分ではありません。
研究グループは、ヒト大腸がん由来の上皮様培養細胞株(Caco-2細胞[2])を単離培養すると、細胞質の流動を伴って細胞核が時計回りに回転することを発見しました。実験と理論解析の結果、この回転運動にはタンパク質のアクチン[3]とミオシン[4]が同心円状に配置した「アクトミオシンリング」という構造の形成が関与しており、同心円構造の空間パターン自体はキラリティを持たないにもかかわらず、それを構成している分子が示すキラリティが細胞スケールのキラル[1]な回転流を生み出せることを示しました。
本研究は、科学雑誌『eLife』オンライン版(8月26日付)に掲載されました。
細胞キラリティを駆動するアクトミオシンリング
背景
生き物の体やその構成要素である器官には、左右非対称にできているものが多くあります。この左右非対称性はランダムに生じるのではなく、例えばカタツムリの殻では、右巻き・左巻きが種ごとにおおよそ決まっていることや、ヒトの心臓はほとんどの場合、体の左側に位置することなど、種によって一貫している場合が多いことが知られています。しかしながら、このような左右非対称性がどのようにして決定されるのかは、脊椎動物の初期発生やショウジョウバエの器官形成などで詳しく調べられてきましたが、いまだに明解な理解には至っていません。
左手と右手のように、3次元の物体がその鏡像と重ね合わせられない性質をキラリティといいます。興味深いことに、器官や組織のキラリティには、しばしば細胞スケールのキラリティ(細胞キラリティ)が伴っています。従って、細胞キラリティを理解することは、生き物の体に見られる左右非対称性の仕組みを解明する手がかりとなる可能性があります。
細胞キラリティは、神経細胞の突起が時計回りに伸びたり、培養皿上で繊維芽細胞の細胞骨格[3]がらせんパターンを示したりなど、さまざまな細胞で観察されています。タンパク質やDNAなど、細胞を構成している生体分子のほとんどはキラルな性質を持っているので、それらの生体分子が原因となり、細胞にキラルな性質が生まれると考えられます。また近年、キラルな性質を持った生体分子の中でも、細胞が力を生成する際に関わる細胞骨格関連分子が細胞キラリティ形成に関与することが明らかにされてきました。例えば、アクチンやミオシン、また、フォルミン[5]などのアクチン関連タンパク質、また、微小管やそれに関連するモータータンパク質[4]が、細胞キラリティに関わる因子として知られています。しかし、これまでの研究では、分子スケールのキラリティがどのように空間的に協調して細胞スケールのキラリティを引き起こすのかについての詳細なメカニズムの理解は十分ではありませんでした。
本研究では、上皮様の培養細胞であるCaco-2細胞を用いて、細胞骨格が細胞内でどのような空間的秩序を持つことで細胞キラリティを生み出すのかについて、実験と理論を組み合わせることで解き明かしました。
研究手法と成果
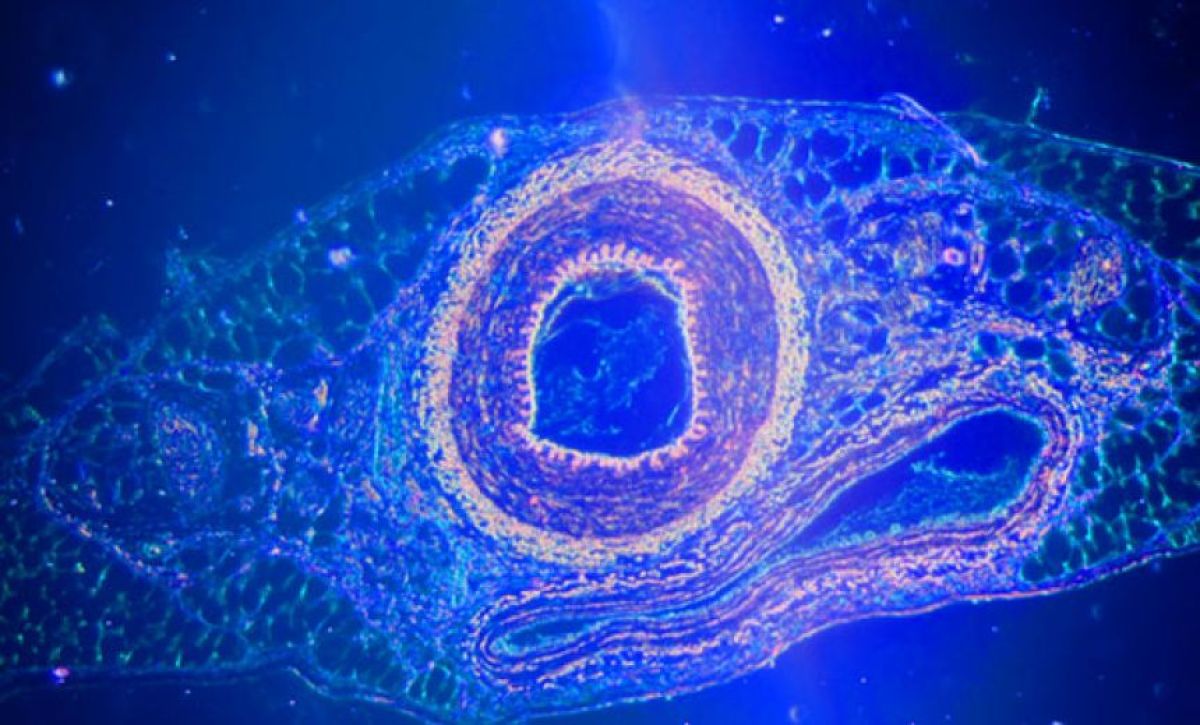
研究グループは、ヒト大腸腺がん由来の上皮様細胞(Caco-2細胞)を1細胞に単離した状態で培養皿の上で培養すると、細胞を上から見たときに核や細胞質が時計回りに時速約50度の速さで回転することを発見しました(図1)。回転した細胞は全て時計回りに回転運動をしており、Caco-2細胞は明確な細胞キラリティを持つことが分かりました。
図1 時計回りに回転するCaco-2細胞
1細胞状態で単離培養したCaco-2細胞を光学顕微鏡(微分干渉顕微鏡)で30分ごとにタイムラプス観察した。画像中央に核があり、薄く細胞辺縁部が広がっている様子が見える。中央の赤い線は、核回転を定量するために核の模様(核スペックル)を指標として追跡したもの。経時的に時計回り方向の回転をしていることが分かる。スケールバーは20マイクロメートル(μm、1μmは1,000分の1ミリメートル)。
細胞が回転運動を行うためには、何らかの駆動力が必要になります。そこで研究グループは、細胞骨格に関与するタンパク質がCaco-2細胞における細胞キラリティの形成に寄与しているのではないかと考えました。
そこでまず、主要な細胞骨格要素であるアクチン(アクチン繊維)と微小管が細胞内でどのような空間パターンを形成しているかを観察しました。興味深いことに、これらの細胞骨格は細胞内で渦巻き状の空間パターンを示していました。具体的には、アクチン繊維は細胞の辺縁部において右巻きのパターンを、微小管は細胞全体に広がって左巻きのパターンを呈していました(図2)。これらの観察結果から、細胞骨格がCaco-2細胞の細胞キラリティの発現に関与していると予想しました。
図2 Caco-2細胞内の細胞骨格
1細胞状態で単離培養したCaco-2細胞の蛍光顕微鏡観察。赤色でアクチン繊維を、緑色で微小管を示した。細胞辺縁部に局在したアクチン繊維(ストレス繊維)が顕著に見え、細胞中心から辺縁部に向かって右巻きの渦巻きパターンを持っている。一方で微小管は細胞全体に広がっており、細胞中心から辺縁部に向かって左巻きの渦巻きパターンを持っている。スケールバーは20μm。
次に、これらの細胞骨格の機能を薬剤で阻害することで、細胞骨格がどのように細胞キラリティに関与しているかを調べました。微小管の形成(重合)を阻害しても核の回転は維持された一方で、アクチン繊維の重合や脱重合を阻害すると、核の回転は止まりました。これにより、細胞キラリティの形成には、微小管ではなくアクチン細胞骨格が重要であることが明らかになりました。
さらに、アクチン細胞骨格の働きを調べるため、アクチン繊維の運動を駆動するモータータンパク質であるミオシンII[4]の働きを調べました。ミオシンIIの運動を薬剤で阻害すると、アクチン繊維の重合・脱重合を阻害したときと同様に、細胞の回転運動は止まりました。これらの結果から、Caco-2細胞における細胞キラリティの形成にはアクチン繊維とミオシンIIの両者が不可欠であることが示されました。
細胞内では、ミオシンII以外にもさまざまな「アクチン関連タンパク質」がアクチン繊維と結合・解離することで、アクチンの機能を制御しています。そこで、これらのアクチン関連タンパク質の機能を阻害することで、アクチン細胞骨格がどのようにして細胞キラリティを生み出しているのかを調べました。
その中で、アクチン繊維の重合に関わり、アクチン繊維を特定の方向に回転運動させることが知られているフォルミンを阻害した際に、興味深い現象が観察されました。通常、Caco-2細胞のアクチン繊維は細胞辺縁部に右巻きの渦状パターンを形成しますが、フォルミン阻害によりこのパターンは消失しました。一方、核周囲には、アクチン繊維とミオシンIIから成る同心円状のアクトミオシン構造が顕著に現れることが分かりました。驚くべきことに、フォルミンの阻害により右巻きの渦状パターンという空間的なキラリティがなくなったにもかかわらず、細胞の時計回りの回転運動は減速するどころか、むしろわずかに加速しました。この結果は、細胞キラリティの起源が細胞辺縁部のアクチン渦巻きパターンではなく、むしろ核周囲に形成されるアクトミオシンの同心円構造にある可能性を示唆しています。研究グループはこの同心円構造を「アクトミオシンリング」と名付け、アクトミオシンリングの細胞内空間配置やその動的振る舞いを、超解像顕微鏡法[6]を用いて詳しく調べました。
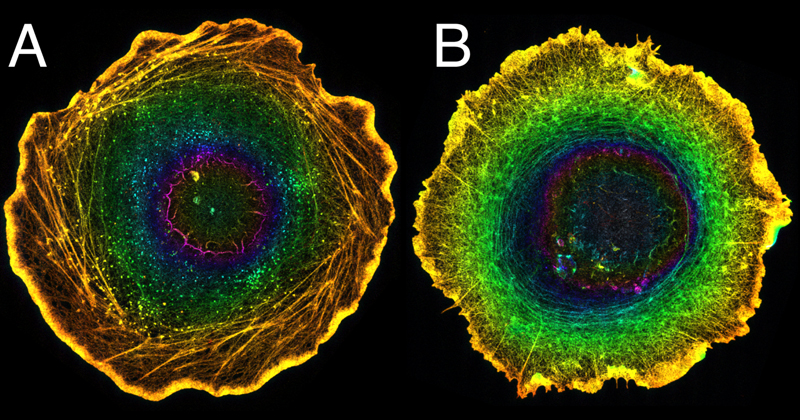
超解像顕微鏡法による細胞内構造の詳細な観察から、アクトミオシンリングは細胞の背側(細胞が培養皿に接着する側の反対側。上面)に形成されることが明らかになりました。また、通常のCaco-2細胞でも細いアクトミオシン繊維が核の周りを取り巻くように形成されていることが分かりました(図3A)。一方、フォルミンの働きを阻害した場合は、より顕著にアクトミオシンリングが形成されることが見て取れます(図3B)。
図3 超解像顕微鏡法(拡張顕微鏡法)を用いたアクチン繊維の局在解析
対照群のCaco-2細胞(A)とフォルミン阻害群(B)における、アクチン繊維の細胞内局在。アクチン繊維が分布する高さを疑似色で表しており、Caco-2細胞の底面から上面に向かうに連れて黄色→緑色→青色→赤紫色で高さごとにアクチン繊維を色分けしている。
- (A)対照群では、右巻きのアクチン繊維(ストレス繊維)が底面に局在し(黄色)、また核とストレス繊維の間の領域(緑色)に細い同心円状のアクチン繊維が存在していた。
- (B)フォルミン阻害群では、渦巻き状のストレス繊維は消失し放射状のアクチン繊維が顕著に観察され(黄色)、一方でキラリティを持たない同心円状のアクチン繊維(アクトミオシンリング)が顕著に観察された(緑色)。
次に、これらのアクチン繊維の動きを詳細に調べました。観察から、アクトミオシンリングが細胞内で核を取り囲むように、時計回りに運動していることが分かりました。さらに、粒子画像流速測定法[7]という方法を使って細胞のさまざまな場所における細胞質の運動速度を定量した結果、回転速度が一番大きいのは、アクトミオシンリングが形成される場所でした。これらの結果は、アクトミオシンリングが細胞の回転運動の駆動力であることを強く示唆しています。
一見するとキラルな性質を持たない同心円構造のような対称な構造が、細胞の時計回り運動という動的なキラリティを生みだすことは可能なのでしょうか。
このメカニズムを解明するために、研究グループは理論的手法を用いることにしました。モーター分子のように自ら動く要素の集まりは「アクティブマター[8]」と呼ばれ、その性質は生物学的にも物理学的にも興味深い研究対象として注目されています。研究グループは、駆動力とキラルな性質を同時に合わせ持つアクティブマターの運動を記述する理論的なフレームワーク「アクティブカイラル流体力学」に基づいたシミュレーションと解析を行いました。ミオシンIIは、モータータンパク質として駆動力を生み出すときに、アクチン繊維を回転運動させることが知られています(図4A)。このことから、アクチン繊維とミオシンIIの組み合わせであるアクトミオシンは、収縮力に由来する力の双極子[9]と回転運動に由来するキラルなトルクの双極子[10]の二つの駆動力を持ちます。
研究グループは、これらの二つの駆動力が組み込まれた流体理論であるアクティブカイラル流体力学に従って、アクトミオシンによって駆動される細胞質のダイナミクスを記述できると考えました。アクトミオシンリングが細胞の背側の膜に同心円状に分布することを考慮に入れて、アクティブカイラル流体力学の流体方程式を有限要素法[11]により解いたところ、背側に分布するアクトミオシンリングは、実際のCaco-2細胞と同様に、細胞の中心方向に向かう流れと、時計回りの流れとを組み合わせた細胞質流を生みだせることが分かりました(図4B、C、D)。さらにシミュレーションの結果から、この回転運動の形成には、アクトミオシンが細胞の背側に分布していることが必要であることが理論的に示されました。この理論的予測を確かめるために、薬剤を用いて、背側のアクチン繊維とミオシンIIをCaco-2細胞の腹側に偏らせる実験を行いました。理論予測通り、アクトミオシンの背側の分布を阻害すると、核や細胞質の回転運動は止まりました。
以上の結果から、キラルな性質を持たない同心円構造のアクトミオシンリングが背側に存在することで、Caco-2細胞の細胞キラリティを形成していることを裏付ける結果を得ました。
図4 細胞キラリティ形成の理論モデルの概念図と計算結果
- (A)アクトミオシンリングでアクトミオシンが生成する力の双極子およびトルクの双極子の概念図。 (B、C、D)は、アクティブカイラル流体の数値計算で用いたアクトミオシンの分布と、速度場の計算結果を表す。図は、細胞の中心からの断面で、横軸は中心からの距離(半径)、縦軸は各グラフで示された変量を示した。
- (B)同心円のアクトミオシンの分布。赤色はミオシンが多く分布している領域。
- (C)回転方向の速度分布、青色の領域は、細胞を上から見たときに時計回りの方向に回転運動が生じていることを示し、実験結果と整合している。物理や数学では、角度は反時計回りの方向に正の値を取る。つまり、速度が負の値のとき、流れが時計回りの方向に向いていることを示す。
- (D)断面内の速度分布。矢印は流れの方向と大きさを示す。
今後の期待
さまざまな種類の細胞が細胞キラリティを示しますが、その形成メカニズムに共通性があるのか、それとも細胞種ごとに違っているのかは明らかではありません。本研究から、細胞キラリティを形成する分子メカニズムの一端が見えてきました。今後は、Caco-2細胞以外の細胞種を解析することで、普遍的な細胞キラリティ形成メカニズムが存在するかを明らかにする必要があります。
一方で、上皮細胞由来であるCaco-2細胞は互いに接着することで多細胞体も形成するため、組織・器官スケールのキラリティ形成のモデルとなる可能性があります。Caco-2細胞は多細胞でもキラリティを示すのか、そして多細胞キラリティを示すならば、単細胞のキラリティからどのようにして多細胞キラリティが生み出されるのかは、今後明らかにしていく課題です。
今後も研究グループは、分子スケールのキラリティから、細胞キラリティ、ひいては体や器官の左右非対称性へと、階層を超えてキラルな性質が自発的に生まれてくるメカニズムを明らかにしていきたいと考えています。
補足説明
- 1.キラリティ、キラルキラリティとは、物体が鏡像(鏡に映した像)と完全に重ね合わせることができない性質を指す。例えば私たちの手は、左手と右手で鏡像関係にあり、左右の手を完全に重ね合わせることはできないため、キラリティがある(キラル)といえる。
- 2.Caco-2細胞ヒトの結腸腺がん由来の上皮様培養細胞株。腸上皮モデルとして研究に用いられることが多い。
- 3.アクチン、細胞骨格アクチン1分子は直径約5ナノメートル(nm、1nmは10億分の1メートル)の球状タンパク質。アクチンが集合してひも状になったアクチン繊維は、細胞骨格として機能する。細胞骨格は、細胞を内部から支える分子。さまざまなパターンのネットワークを形成することで細胞の形の維持や変形、細胞運動、細胞分裂、細胞内輸送など多くの動的なプロセスに関わっている。
- 4.ミオシン、モータータンパク質、ミオシンII細胞内でアデノシン三リン酸(ATP)の分解で生じる化学エネルギーなどを用いて、力学的な仕事をするタンパク質をモータータンパク質と呼び、ミオシンやキネシン、ダイニンがその代表例。ミオシンIIはアクチン繊維上を動くモータータンパク質であり、非筋細胞では局所的に重合してアクチン繊維を介した力生成を行う。
- 5.フォルミンアクチンの重合核を形成する因子の一種で、アクチン繊維を伸ばす。アクチン繊維は二重らせん構造を取り、フォルミンは、アクチン繊維を伸ばす過程でこのらせんに沿ってアクチン繊維を回転させることが知られている。
- 6.超解像顕微鏡法超解像顕微鏡法とは、光学顕微鏡の分解能を上回る高解像度情報を得る手法の総称。光学顕微鏡では、光の波長程度より高い分解能(異なる2点を分離して検出できる限界)を得られず、その限界は約200nmとされてきた。この限界を超えるため、異なる原理による超解像顕微鏡法が開発されている。本研究では、拡張顕微鏡法や格子光シート顕微鏡を用いた。
- 7.粒子画像流速測定法動画の連続フレームを比較することによって、画像の各ピクセルでの速度場(速度の空間分布)を測定し可視化する方法。
- 8.アクティブマター自ら動く力を持つ要素の集まり。鳥や魚の群れといった生物個体の集団だけではなく、細胞集団や非生物の人工粒子系などに対しても用いられる。
- 9.力の双極子微小な距離を隔てた2点において、大きさが等しく向きが逆の二つの力が同時に作用している状態。
- 10.トルクの双極子微小な距離を隔てた2点において、大きさが等しく向きが逆の二つのトルクが同時に作用している状態。トルクとは物体を回転させる力のモーメントであり、回転軸の方向を向いた軸性ベクトルで表される。
- 11.有限要素法偏微分方程式の数値解を求めるための手法で、計算領域を小さな要素(メッシュ)に分割し、それぞれの要素上で近似関数を用いて解を構築する方法。
研究グループ
理化学研究所 生命機能科学研究センター フィジカルバイオロジー研究チーム 研究員(研究当時)山本 尚貴(ヤマモト・タカキ) (現 開拓研究所 川口生体非平衡物理学研究室 客員研究員) 基礎科学特別研究員 石橋 朋樹(イシバシ・トモキ) 研究員(研究当時)多羅間 充輔(タラマ・ミツスケ) (現 九州大学理学研究院 物理学部門 助教) チームディレクター 柴田 達夫(シバタ・タツオ) 分子細胞動態研究チーム(研究当時) チームリーダー(研究当時)清末 優子(キヨスエ・ユウコ) テクニカルスタッフⅠ(研究当時)徳重 直子(トクシゲ・ナオコ) (現 生命機能科学研究センター フィジカルバイオロジー研究チーム テクニカルスタッフⅠ) 高次構造形成研究チーム(研究当時) チームリーダー(研究当時)竹市 雅俊(タケイチ・マサトシ) (現 理研名誉研究員、生命機能科学研究センター 神経幹細胞研究チーム 客員主管研究員)
テクニカルスタッフⅡ(研究当時)シルヴァン・イベル(Sylvan Hiver)