薬の副作用メカニズムに関わる新たなゲノム制御領域を発見-ヒト肝細胞における薬剤誘導性エンハンサーを網羅的に解析-
ゲノム医学研究センターの齊藤紗希 主任研究員、川路英哉 センター長らの研究グループは、ヒト肝細胞を用いて、薬の副作用メカニズムに関連する新たなエンハンサーを同定し、その機能を明らかにしました。本研究成果は、2025年4月29日(火)18時(日本時間)に科学誌Nature Communicationsオンライン版に掲載されました。
- <論文タイトル>
- “Drug-induced cis-regulatory elements in human hepatocytes affect molecular phenotypes associated with adverse reactions”
- <発表雑誌>
- Nature Communications DOI:https://doi.org/10.1038/s41467-025-59132-3
- 薬剤により誘導される遺伝子発現調節領域を網羅的に同定ヒト肝細胞モデルにおいて、薬剤により誘導される遺伝子発現調節領域を網羅的に同定したところ、生体内ビタミンD濃度に関する表現型と相関する一塩基多型(注1) が顕著に集積していることを明らかにしました。一部の薬剤が引き起こす副作用としてビタミンD欠乏症が報告されていますが、その分子的機序を示唆する新たな知見です。
- 薬物代謝酵素 UGT1A1 遺伝子の発現を増加させる新たなエンハンサーを発見UGT1A1(注2) 遺伝子のエンハンサー(注3) として従来知られる PBREM と相同性の高い DNA 塩基配列を有する「PBREM-like」や、UGT1A1 遺伝子のイントロン内に位置する特定の領域が、同遺伝子の発現を強力に増加させることを、CRISPR/Cas9 によるゲノム編集(注4) やルシフェラーゼレポーターアッセイ(注5) を用いて実証しました。
- ビタミンD代謝に関わる分子ネットワークの一端を解明活性型ビタミンDの不活性化酵素である CYP24A1(注6) 遺伝子が、薬剤誘導性エンハンサーによって活性化されること、またその活性を左右する一塩基多型を明らかにしました。さらに、これまでビタミンD代謝の研究において着目されることがなかった遺伝子である TSKU(注7) がビタミンD代謝に関連する遺伝子群の発現に影響を与えること、ならびに TSKU 遺伝子の発現を薬剤誘導的に増加させるエンハンサーを発見しました。
私たちが薬を服用した際に生じる効果や副作用には個人差があり、その一因として遺伝要因が関与していることが知られています。これまで、タンパク質をコードする領域の遺伝子多型と薬剤応答性の関係に着目した研究が数多く実施されてきました。近年、体質や疾患に関わる一塩基多型の多くが、タンパク質をコードする領域ではなく、遺伝子の発現を調節するゲノム領域 (シス制御エレメント(注8) ) に集積していることが明らかにされています。特に、遺伝子から離れた位置に存在し、遺伝子のスイッチ役として機能するエンハンサーの遺伝子多型は、大きな注目を集めています。
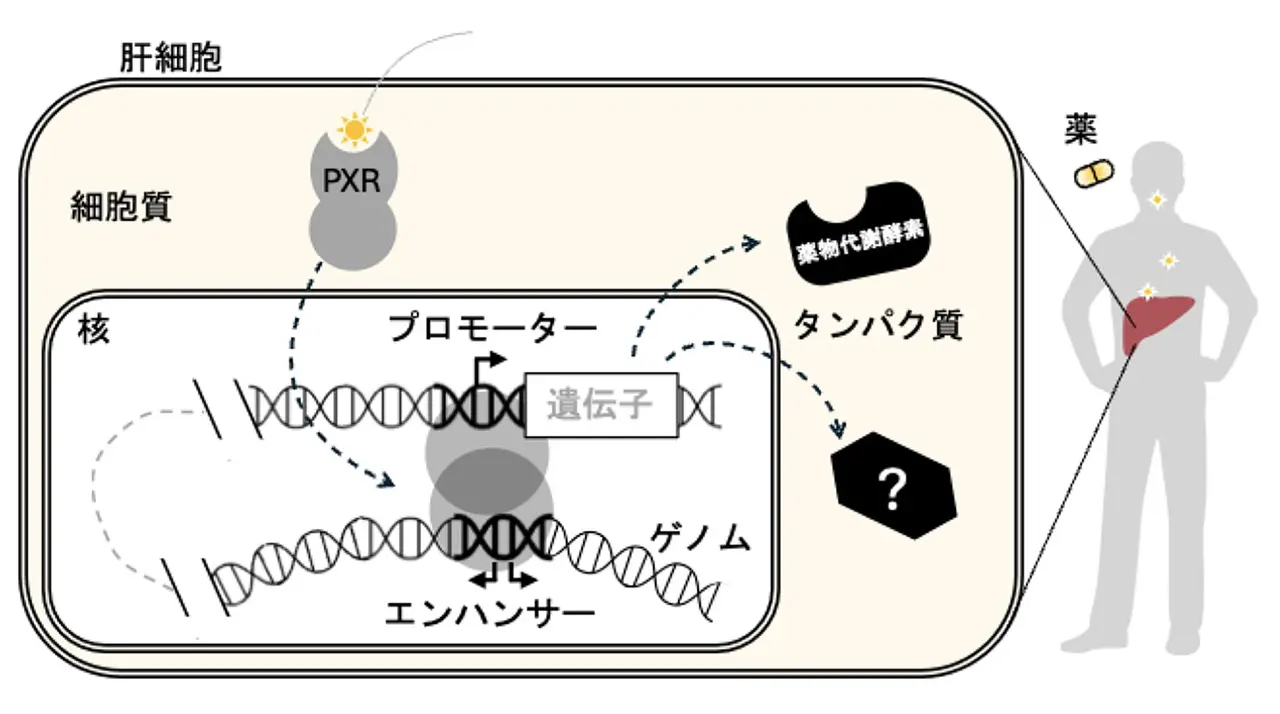
様々な物質の代謝を担う肝臓では、多くの医薬品により活性化される薬剤応答性の転写因子である PXR(注9) が、薬物代謝酵素をはじめとする数多くの遺伝子発現を調節することが知られています。PXR がゲノム上の遺伝子発現制御領域に結合することで発現が調節されますが (図1) 、ゲノム上のどの領域が PXR により認識されるシス制御エレメントとして機能しているのか、その全体像は明らかになっていませんでした。
本研究では、ヒト肝細胞において薬剤によって誘導されるシス制御エレメントの網羅的な同定とその機能解析に取り組みました。
研究グループは、ヒト PXR が発現するヒト肝癌由来細胞株に、PXR の代表的な活性化薬であるリファンピシンを処置することで、薬剤応答に関するヒト肝細胞モデルを準備しました。遺伝子の転写開始点の RNA 発現量を定量的に測定する CAGE(注10) 法を用いてこの細胞モデルを測定し、そのデータ解析を行うことで、薬剤により誘導されるシス制御エレメントの候補を同定しました。ゲノムワイド関連解析 (GWAS)(注11) を通じて報告されたヒトの表現型に関連する一塩基多型と比較したところ、同定した候補領域には生体内ビリルビン濃度やビタミンD濃度と相関するゲノム多型が顕著に集積していることが明らかになりました。
続いて、ヒト初代培養肝細胞において測定された PXR 結合領域の実験データを組み合わせることで、生理的な機能領域を絞り込みました。そのうちの二箇所について CRISPR/Cas9 によるゲノム編集やルシフェラーゼレポーターアッセイを用いて実際に機能を検証したところ、これらは抗がん剤イリノテカンの副作用に関わる UGT1A1 遺伝子の発現を増加させる新たなエンハンサーであることが明らかになりました。UGT1A1 遺伝子のエンハンサーとして従来知られる PBREM と相同性の高い DNA 塩基配列を有する「PBREM-like」や、UGT1A1 遺伝子のイントロン内に位置する特定の領域が、同遺伝子の発現調節において重要な役割を果たすことを示す新たな知見です。さらに UGT1A1 の発現を左右する一塩基多型も同定され、がん治療における安全性評価系の構築に貢献することが期待されます。
また、活性型ビタミンDの不活性化酵素であるCYP24A1 遺伝子が薬剤誘導性エンハンサーによって活性化されること、またその活性を左右する一塩基多型を明らかにしました。加えて、これまでビタミンD代謝の研究において着目されることがなかった遺伝子であるTSKU がビタミンD代謝に関連する遺伝子群の発現に影響を与えることを初めて見出すとともに、TSKU 遺伝子の発現を薬剤誘導的に増加させるエンハンサーを明らかにしました。一部の薬剤が引き起こす副作用としてビタミンD欠乏症が報告されていますが、これらの結果は、その分子的機序を示唆する初めての知見です。
本研究は、これまで機能的理解が難しかったゲノム領域であるシス制御エレメントに焦点を当て、薬の副作用に関わる分子メカニズムの一端を明らかにしました。医薬品による治療効果や副作用発現は個人差があることから、これを予見し、コントロールすることは適切な治療を計画する上で極めて重要です。本研究は、そのような個人差を正確に把握する上での手掛かりとなるものであり、個別化医療の高度化へ向けた基盤となることが期待されます。また、ヒトゲノムの 98〜99% を占める非コード領域が果たす役割は未だ十分に解明されていないことから、今回の研究で用いた方法論を適用することで、ヒトゲノムのより広範な機能的理解が進むことが期待されます。
- 注1) 一塩基多型 :
- DNA の塩基配列において1つの塩基が置き換わった遺伝的変異で、集団内で1%以上の頻度で認められる。
- 注2) UGT1A1 :
- 肝臓で働く薬物代謝酵素 UDP-グルクロン酸転移酵素の1分子種。ヘムの分解産物であるビリルビンや抗がん剤イリノテカンの代謝に関与する。
- 注3) エンハンサー :
- 遺伝子の転写量を増加させる作用をもつ非コード DNA 領域。シス制御エレメントのひとつ。
- 注4) ゲノム編集 :
- CRISPR/Cas9 などの部位特異的ヌクレアーゼを利用して、標的ゲノムの配列を自在に改変する技術。
- 注5) ルシフェラーゼレポーターアッセイ :
- 遺伝子のシス制御エレメントの調節のもとに発現するルシフェラーゼ酵素からの発光量を測定することにより、転写活性化能を解析する手法。
- 注6) CYP24A1 :
- 活性型ビタミンDを不活性化する代謝酵素。ビタミンD代謝の中心的役割を果たす。
- 注7) TSKU :
- 肝臓から分泌されるホルモンであるヘパトカインの一種。エネルギー消費に関わることが報告されている。
- 注8) シス制御エレメント :
- 遺伝子の転写を制御するDNA塩基配列のことで、代表的なものにエンハンサーやプロモーターなどが存在する。
- 注9) PXR :
- 肝臓や腸に高発現し、医薬品を含む幅広い化学物質により活性化される薬剤応答性の転写因子。薬物代謝酵素の発現調節に重要な役割を果たす。
- 注10) CAGE :
- Cap Analysis of Gene Expression の略称。転写された RNA の 5' 末端の塩基配列を一塩基レベルで同定・定量する技術。
- 注11) ゲノムワイド関連解析 (GWAS) :
- 特定の疾患や体質などに関連する遺伝的な特徴を網羅的に調べるために用いられる手法及びその研究。
<主な助成事業>
本研究は、科学技術振興機構 (JST) 統合化推進プログラム「統合的な転写制御データ基盤の構築(研究代表者:粕川雄也、JPMJND2202)」、⽇本医療研究開発機構 (AMED) ゲノム創薬基盤推進研究事業 「RNA 標的医薬創出に資する、疾患 RNA 分⼦完全⻑⼀次構造に関するデータ基盤の構築 (研究代表者 : 川路英哉、23kk0305024) 」、武田科学振興財団 特定研究助成 「大脳皮質形成時の神経細胞移動を支えるゲノム機能・構造的基盤の解明 (研究代表者 : 川路英哉)」、科学研究費補助金 JSPS KAKENHI 「網羅的 eRNA 発現解析による薬剤応答性エンハンサーの同定と機能解析 (研究代表者:齊藤紗希、23K06396)」、武田科学振興財団 医学系研究助成金 「創薬応用を目指した薬剤誘導性 eRNA による遺伝子発現制御機構の解明 (研究代表者 : 齊藤紗希)」 および 持田記念医学薬学振興財団 研究助成金 「薬物応答制御の新たな基盤であるエンハンサー RNA を介した遺伝子発現抑制機構の解明 (研究代表者:齊藤紗希)」による⽀援を受けて⾏われました。



