長期兵糧攻めによる難治性膵臓がんの克服 ~長時間生体内で安定に酵素を働かせる新型ナノマシンの開発 ~
- 生体内に導入したナノマシンを長期に渡り異物反応から守るステルスマント(透明マント)の開発に成功:ポリアニオンとポリカチオンからなる安定なイオンペア・ネットワークをナノマシン表面に構築し、タンパク質の吸着やマクロファージからの攻撃を防ぐ構造を考案
- 血中投与後の生体内半減期が100時間以上となる超長期生体内循環を達成(これまでのステルスマントの約10倍)
- L-アスパラギンの分解酵素であるアスパラギナーゼを搭載したナノマシンが生体内を長期循環し、がん細胞が生き延びるために必要な L-アスパラギンを腫瘍組織から枯渇
- マウスモデルで難治性乳がんの兵糧攻めによる治療の有効性を確認
- さらに膵臓がんへの薬剤(免疫チェックポイント阻害剤など)の侵入を阻む厚い間質(線維質)を破壊し、がん免疫療法との相乗効果で極めて高い有効性(長期生存)を達成
- 発表内容を記した論文:Junjie Li*, Kazuko Toh, Panyue Wen, Xueying Liu, Anjaneyulu Dirisala, Haochen Guo, Joachim F. R. Van Guyse, Saed Abbasi, Yasutaka Anraku, Yuki Mochida, Hiroaki Kinoh, Horacio Cabral, Masaru Tanaka, and Kazunori Kataoka*Nature Biomedical Engineering, オンライン限定誌DOI: https://doi.org/10.1038/s41551-025-01534-1Full Paper: https://rdcu.be/eNHPP
川崎市産業振興財団 ナノ医療イノベーションセンター(センター長:片岡一則、所在地:川崎市川崎区、略称:iCONM)、国立大学法人九州大学(総長:石橋達朗、所在地:福岡市西区、略称:九州大学)先導物質化学研究所、国立大学法人東京科学大学(理事長:大竹尚登、略称:Science Tokyo)および国立大学法人東京大学大学院工学系研究科(研究科長:加藤泰浩、略称:東京大学)は、共同研究成果として、「立体的な安定性に依存しない透明マントが、難治性がんに対するナノ製剤の飢餓療法を可能にする」 と題する論文が、Nature Biomedical Engineering(注1)に11/1 午前1時(JST)付でオンライン掲載されたことを報告致します。
医薬品は静脈注射後、血流に乗って患部へ運ばれ効果を示します。しかしながら、その多くは腎臓から尿中へ、あるいは肝臓から胆汁中へ消失し、または代謝により化学構造が変化するために、実際に作用する量は限定的です。ナノ医療は、そういった従来の薬物療法の効率を改善する目的で、数十ナノメートルのサイズの担体(ナノミセル/ナノマシン)に薬剤を内包し、より多くの量の薬剤が患部に集中して届くようにしたものです。しかし、そのナノマシンも生体から異物として認識されてしまうと免疫細胞の攻撃を受けて破壊されてしまいます。そのため、ナノマシンを生体内にできるだけ長く留めるためには、厳しい免疫監視システムから逃れる透明化技術が必要となります。例えば、ポリエチレングリコール(PEG)で外側を覆うステルスマント(透明マント)は広く利用されています。しかしながら、「飢餓療法」として、がん細胞の生育に不可欠ながんにとっての栄養素を枯渇させるような療法にナノ医療を応用するためには、より長い生体内半減期を持つナノマシンを開発する必要があります。本論文では、ナノマシンの構成ユニットとなるブロックポリマーにおいて、ポリカチオンとポリアニオンからなるイオンペア・ネットワークを介して達成されたステルス効果について報告します。構成ポリイオン間の架橋を特定の閾値を超えて増加させることで、タンパク質の吸着とマクロファージの取り込みを減少させ、半減期が100時間を超える体内循環を可能にすることを示しました。これを基に、がん細胞の生育に必須となるL-アスパラギンを分解するアスパラギナーゼを搭載したナノマシンを、半透過性のイオンペア・ネットワークでステルス化してがん組織の兵糧攻めを試みました。体内循環における半減期が延びたことで、持続的なアスパラギン飢餓が引き起こされ、転移性乳がん(注2)および膵臓がん(注3)に対する治療結果が改善されました。これらの発見は、安定した分子間構造を精巧に設計することで、治療を目的とした薬物送達のためのナノ材料の薬物動態を改善する新たな道を開くと期待されます。
<本研究の新規性>
- PEGに依存しないステルスマント:イオンペア・ネットワーク。従来の「立体反発(PEG)」ではなく、ポリカチオンとポリアニオンの協働的な架橋により表面にシース状のイオンペア・ネットワークを形成。タンパク質吸着やマクロファージ取り込みを抑え、生体内半減期 >100 時間という長期循環を実現しました。
- 「薬を入れる」から「環境を変える」へ。アスパラギナーゼ搭載の小胞型ナノ反応器が血中で持続的に L-アスパラギンを枯渇させ、全身性の兵糧攻めで固形がんの治療感受性を高めます(ALL/LBL に限られてきた戦略の拡張)。
- 膵がんの厚い間質を和らげ、免疫療法を“通す”。KPC 膵がんモデルで、アスパラギン枯渇によりデスモプラジアが緩和し、抗 PD-1 抗体の広範な浸潤が可能になりました(小胞の腫瘍集積は低いままでも効果が出る点が特徴)。
- 概念的前進:体内で働く“ナノマシン”。高集積に依存せず、長期循環するナノマシンが代謝・微小環境を改変して他剤(例:抗 PD-1)を“通す”という新しい治療観を示しました。
<将来的な社会への貢献>
- 代謝改変療法の適応拡大。日単位で酵素活性を維持できるプラットフォームにより、兵糧攻め(飢餓療法)を難治性固形がんへ広げる道が開けます。
- 膵がんでの免疫療法活性化。間質の緩和により免疫チェックポイント抗体が機能しやすくなり、難治がんでの併用療法の可能性が広がります。
- 一般化可能なステルス設計。イオンペア・ネットワークという材料学的設計則は、PEG 非依存で長期循環・非ファウリングを実現し、将来のドラッグデリバリー、診断、酵素治療に有用です。
- 臨床実装に向けた汎用性。標的集積よりも全身代謝・微小環境の調整を軸にするため、がん種横断での適用拡大・設計簡素化が期待できます。
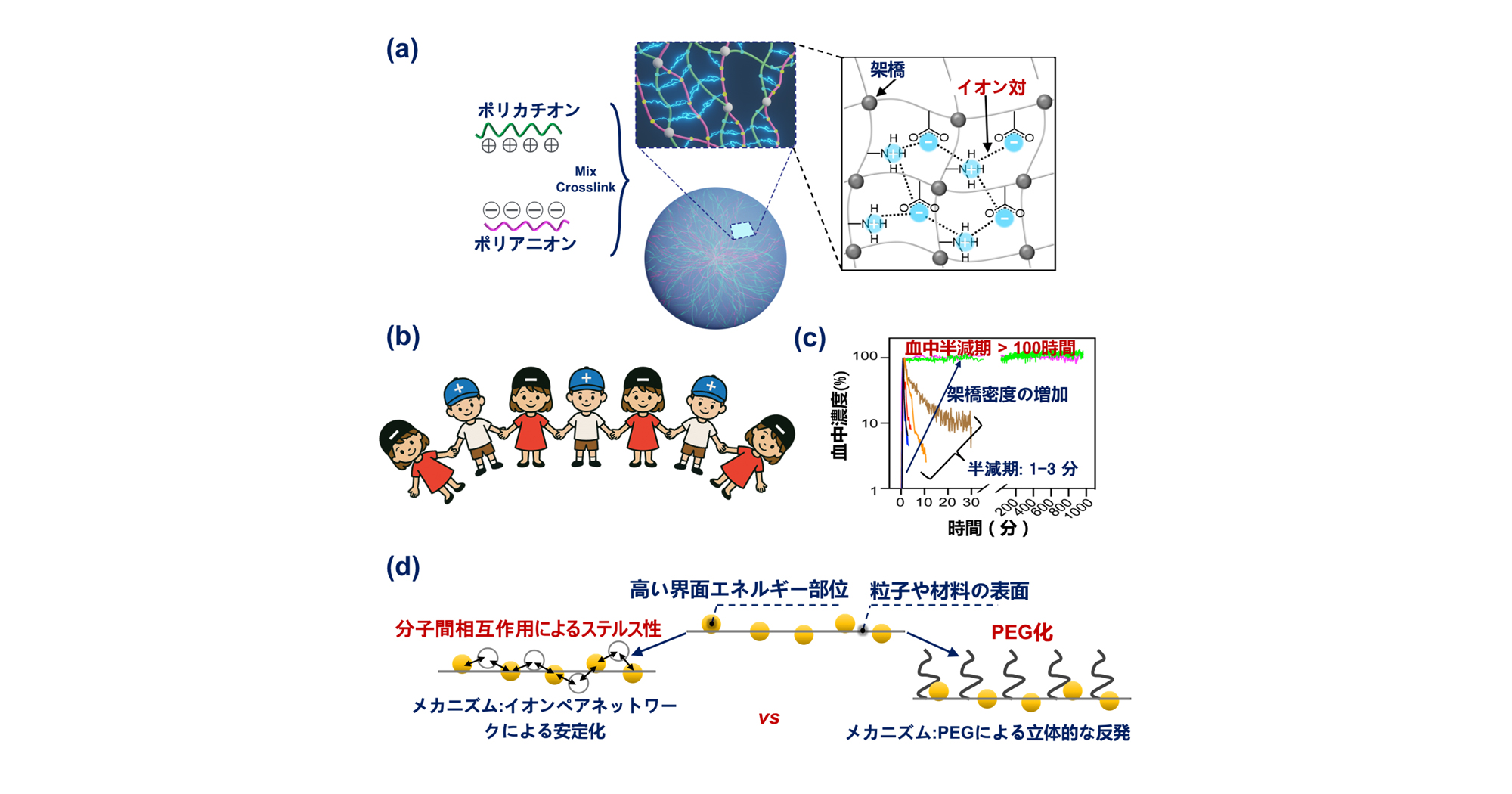
図1. ステルス・イオンペアネットワークはどのように調製され、どのように機能するのか? (a) ポリカチオンとポリアニオンを混合し、架橋することで安定なイオンペア・ネットワークを形成する模式図。(b) イオンペア・ネットワーク・クロークの模式的なイラスト。(c) 架橋度の異なるイオンペア・ネットワークで被覆したナノマシンの血中濃度の時間依存的変化。(d) イオンペア・ネットワーク・クロークと従来の PEG クロークとの比較図。
図2. アスパラギナーゼを搭載したステルス・ナノ反応器がアスパラギンを枯渇させ、がん細胞を兵糧攻めのように飢餓状態に導く模式図。
図3. 転移性トリプルネガティブ乳がん(TNBC)モデルにおける、アスパラギナーゼ搭載ステルス・ナノ反応器(ASNase@V)の治療効果。(注2)
図4. 膵がんモデルにおける、アスパラギナーゼ搭載ステルス・ナノ反応器(ASNase@V)と抗 PD-1 免疫療法の併用による治療効果。(注3)
本研究は、文部科学省・科学技術振興機構の「共創の場形成支援プログラム(COI-NEXT)」の支援を受けて進められています。
注1)Nature Biomedical Engineering :1869年の創刊以来、国際的な科学誌と位置付ける Nature誌の医用工学にフォーカスした姉妹誌として 2017年1月に創刊したオンライン限定誌。2024年におけるインパクトファクターは、26.3。https://www.natureasia.com/ja-jp/natbiomedeng/about#journals
注2)乳がんは現在、最も頻度の高いがんであり、日本人女性の乳がん死亡率は年々上昇しています。これは1990年代以降に減少傾向を示している欧米諸国とは対照的です。死亡の主な要因は転移性疾患であり、特にトリプルネガティブ乳がん(TNBC)は極めて悪性度が高く、転移しやすく、予後不良です。転移性 TNBC の5年生存率はわずか約12%にとどまります。
注3)膵がんは「がんの王様」とも呼ばれる最も予後の悪い疾患の一つであり、5年生存率は10%未満にとどまります。最新の免疫療法(抗 PD-1 抗体など)でさえ効果を示さないことが多く、その主な理由は腫瘍を取り囲む強固な間質(線維組織を中心にマクロファージなど様々な細胞が凝集したもので、腫瘍血管を圧迫して免疫細胞の腫瘍への流入を妨げる)が薬剤や免疫細胞の浸透を阻むためです。
公益財団法人川崎市産業振興財団について
産業の空洞化と需要構造の変化に対処する目的で、川崎市の100%出捐により昭和63年に設立されました。市場開拓、研究開発型企業への脱皮、それを支える技術力の養成、人材の育成、市場ニーズの把握等をより高次に実現するため、川崎市産業振興会館の機能を活用し、地域産業情報の交流促進、研究開発機構の創設による技術の高度化と企業交流、研修会等による創造性豊かな人材の育成、展示事業による販路拡大等の事業を推進し、地域経済の活性化に寄与しています。
https://www.kawasaki-net.ne.jp/
ナノ医療イノベーションセンターについて
ナノ医療イノベーションセンター(iCONM)は、キングスカイフロントにおけるライフサイエンス分野の拠点形成の核となる先導的な施設として、川崎市の依頼により、公益財団法人川崎市産業振興財団が、事業者兼提案者として国の施策を活用し、平成27年4月より運営を開始しました。有機合成・微細加工から前臨床試験までの研究開発を一気通貫で行うことが可能な最先端の設備と実験機器を備え、産学官・医工連携によるオープンイノベーションを推進することを目的に設計された、世界でも類を見ない非常にユニークな研究施設です。
https://iconm.kawasaki-net.ne.jp/
九州大学先導物質化学研究所について
新しい機能性分子の合成、新しい分子集積の化学、有機・無機融合材料の化学、先端材料の素子化に関する化学など、多岐にわたる研究に取り組んでいます。各分野の研究グループが連携して、原子・分子・ナノスケールからマクロスケールまでの物質の構造と機能にかかわる基礎学術とその応用化に関する研究を推進しています。ソフトマテリアル学際化学分野の田中賢研究室は、医療機器の表面設計に強みを持っています。
https://www.cm.kyushu-u.ac.jp/
東京大学大学院工学系研究科バイオエンジニアリング専攻についてバイオエンジニアリング専攻は、少子高齢化が進み、持続的発展を希求する社会において、人類の健康と福祉の増進に貢献することを目指します。本専攻では、この目的を達成するために、既存の工学及び生命科学ディシプリンの境界領域にあって両者を有機的につなぐ融合学問分野であるバイオエンジニアリングの教育・研究を推進します。バイオエンジニアリングの特徴は、物質・システムと生体との相互作用を理解・解明して学理を打ち立てるとともに、その理論に基づいて相互作用を制御する基盤技術を構築することにあります。生体との相互作用を自在に制御することで、物質やシステムは人間にとって飛躍的に有益で優しいものに変身し、革新的な医用技術が生まれることが期待されます。このようなバイオエンジニアリングの教育・研究を通じて、バイオメディカル産業を先導し支える人材を輩出するとともに、予防・診断・治療が一体化した未来型医療システムの創成に貢献することを目指します。http://www.bioeng.t.u-tokyo.ac.jp/
プレスリリース本文:PDFファイル
Nature Biomedical Engineering:https://www.nature.com/articles/s41551-025-01534-1