細菌がつくるナノサイズの遺伝子カプセルが進化を促す
-疾患診断におけるバイオマーカーとしての展開に期待-
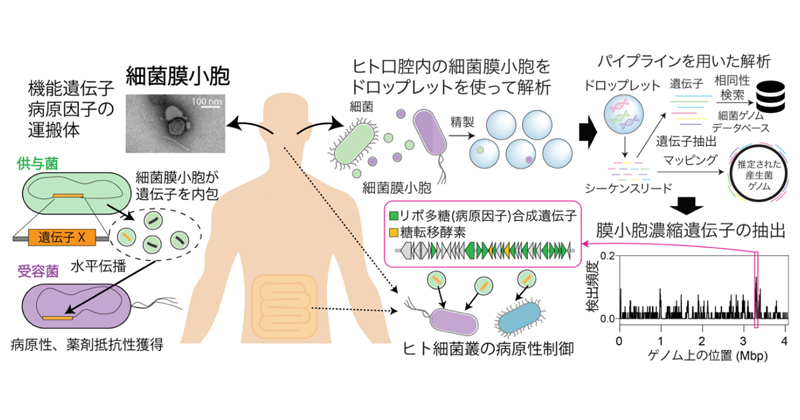
理化学研究所(理研)バイオリソース研究センター 統合情報開発室の高野 壮太朗 開発研究員らの共同研究グループは、細菌がつくり出すナノサイズの粒子(細菌膜小胞[1])に含まれる遺伝子配列を網羅的に解析する技術を開発し、細菌膜小胞がヒトやウイルスとの相互作用に重要な遺伝子を特に多く含んでいること、それらが細菌同士で遺伝子をやり取りする仕組み(遺伝子水平伝播[2])を通じて細菌の進化に重要な役割を果たしてきた可能性が高いことを明らかにしました。
本研究成果は、DNAを運ぶ遺伝子カプセルとしての細菌膜小胞の重要性や細菌がヒトやウイルスとの関わりを進化させるメカニズムに焦点を当てるものです。
今回、共同研究グループは、ドロップレット(微小液滴)を使ったシーケンス(塩基配列解読)技術とゲノム解析技術を活用することで、断片的なDNAの情報を手がかりに細菌膜小胞が由来する細菌種の特定や内包されやすい遺伝子の機能の同定を実施し、歯周病と強く関連する細菌がつくる細菌膜小胞が既報よりも10~100倍程度高い割合で重要な機能を持つ遺伝子を内包することを解明しました。これらの遺伝子はヒト体内に存在する細菌膜小胞にも含まれ、疾患診断におけるバイオマーカーとしての応用も期待できます。
本研究は、科学雑誌『The ISME Journal』オンライン版(9月29日付)に掲載されました。
細菌膜小胞内包遺伝子の重要性と解析アプローチ
背景
膜小胞[3]はヒトをはじめとするさまざまな生き物の細胞膜から産生される直径100ナノメートル(nm、1nmは10億分の1メートル)程度の粒子です。細菌から産生される細菌膜小胞は、その内部に含まれる細菌由来のタンパク質や核酸を介して、細菌間やヒト細胞との相互作用を行う運搬体として知られています。また、腸内細菌叢をはじめとするヒト細菌叢にも大量に存在することから、ヒトの健康に関わる重要な因子としても注目を集めてきました。
細菌膜小胞の代表的な役割の一つに、細菌由来DNA(遺伝子)を運ぶ遺伝子カプセルとしての機能が挙げられます。これまでの研究から、細菌膜小胞を介して、ある細菌から別の細菌へと遺伝子が受け渡される遺伝子水平伝播が細菌の進化を加速させる仕組みとして重要であることが指摘されていました。一方で、細菌膜小胞の大きさは直径50~200nm程度と非常に小さく、微量な内包物質を解析する困難さから、内部の遺伝子の長さや機能的な役割といった詳細な情報については未解明な点が数多く存在していました。また細菌膜小胞ごとに内部に含まれる分子の種類には違いがあることが予想されていましたが、多量の細菌膜小胞をまとめて一つの集団として解析する手法が一般的であり、細菌膜小胞ごとのばらつきを考慮した解析までは行われてきませんでした。
そのため、細菌膜小胞の中にどのような機能を持った遺伝子が多く存在するのか、ヒト体内といった実環境中に存在する細菌膜小胞のうち、機能的に重要な遺伝子を保持しているのはどれくらいの割合なのかは明らかになっていませんでした。
共同研究グループは、こうした課題を解決するため、個々の細菌膜小胞内部に含まれるDNA配列を網羅的に取得・解析することに挑みました。
研究手法と成果
共同研究グループは、歯周病原因菌の一つ、Porphyromonas gingivalis(PG菌)を対象に、産生される細菌膜小胞内部のDNA配列を解析しました。PG菌の培養液から細菌膜小胞のみを回収し、精製した細菌膜小胞をドロップレットに封入して、内部のDNAのみを増幅させた上でシーケンスを行う技術を活用し、個々の細菌膜小胞内部に含まれるDNA配列を網羅的に取得することに成功しました(図1A)。
ドロップレットごとに得られたDNA配列を、産生元のPG菌の染色体ゲノム配列に対してマッピングしていくことで、染色体ゲノム上のどの領域に存在するDNA配列が細菌膜小胞の中に多く存在しているかを明らかにしました(図1B)。
続いて、細菌膜小胞中で頻繁に検出されたゲノム領域に含まれる遺伝子の機能を調べたところ、解析を行った細菌膜小胞の約30%にCRISPR-Cas遺伝子クラスター[4]が含まれることが分かりました。この割合は細菌膜小胞のDNAを染色法によって解析した先行研究注)に比べ、10~100倍程度高い割合であり、今回活用したドロップレットを用いた手法が、従来の染色法に比べて極めて高感度な測定を可能とすることを示しています。
図1 PG菌膜小胞に対する解析結果の一例
従来は精製した数十万~数百万個の細菌膜小胞をまとめて溶解させDNAを抽出していたため、平均化されたDNA配列情報のみが得られていたが、本研究ではドロップレットを活用することで個々の細菌膜小胞内部に含まれるDNA配列を解析した(A)。ドロップレットごとに検出ゲノム領域を明らかにし、多くの細菌で検出される濃縮領域の存在が分かった(B)。内包領域の存在する遺伝子を詳細に解析したところ、代謝遺伝子クラスター(Cobalamin biosynthesis)や細菌―ウイルス相互作用に関わるCRISPR-Cas遺伝子クラスターが多く検出されることが明らかになった(C)。Mbps:M(100万)bps(塩基対)。
また、細菌膜小胞の中に特定の遺伝子クラスターが内包されるメカニズムについても不明のままでした。一般に、細菌膜小胞の産生経路には、大きく分けて、細胞死に伴う産生と、細胞膜変形に伴う産生の二つが知られており、遺伝子クラスターの内包がどちらの産生経路と関連が強いかを調べました。細胞死を引き起こす薬剤と細胞膜変形を誘発する薬剤を添加することで人為的にPG菌の膜小胞産生経路を操作したところ、PG菌が自身の細胞膜を変形させて細菌膜小胞を産生した場合においてのみCRISPR-Cas遺伝子クラスターの濃縮が起こることが分かり、遺伝子の濃縮が特定のメカニズムと結び付いた現象であることを明らかにしました(図2)。
図2 PG菌の膜小胞産生経路による検出DNAコピー数の変化
細胞死を引き起こす薬剤を添加した際の細菌膜小胞産生の様子と定量PCR(ポリメラーゼ連鎖反応)によって検出されたDNAコピー数。通常培養時に検出されていたPG菌膜小胞内包領域の検出量が著しく低下している(A)。細胞膜変形を誘発する薬剤を添加した際の、細菌膜小胞産生の様子と検出DNAコピー数。検出コピー数は通常培養時と比べても、2倍程度になっているが有意な変化は見られない(B)。
続いて、膜小胞に濃縮されていたCRISPR-Cas遺伝子クラスターが進化の過程でどのように広まってきたかを検証するため、PG菌と近縁な約300種類の細菌の系統樹を構築して解析を行ったところ、各細菌間におけるゲノム全体の類似度(生き物としての系統的な近さ)とそれぞれの細菌が持っているCRISPR-Cas遺伝子クラスターの類似度(保持される遺伝子の系統的な近さ)の間には有意な不一致が見られることが明らかとなり、この遺伝子クラスターが進化の過程で遺伝子水平伝播によって広まってきた可能性が強く示唆されました(図3)。
図3 近縁種におけるCRISPR-Cas遺伝子クラスターの分布と系統的関係
PG菌の細菌膜小胞に濃縮されていたCRISPR-Cas遺伝子クラスター(七つの遺伝子)が、同じ属に分類される細菌株にも保持されているかを比較ゲノム解析で調べた結果。クラスターとして存在していた遺伝子は青、ゲノム中の離れた領域に存在していた遺伝子は赤で示している。主要な七つの細菌種に属する株については色で示している。同種であってもCRISPR-Cas遺伝子クラスターを保持するかどうかは株ごとに異なる(A)。また、全ゲノム系統樹とCRISPR-Cas遺伝子クラスターの系統樹を比較したところ両者に有意な不一致が見つかり、遺伝子水平伝播が起きた可能性の高いペアが見いだされた(B)。
さらに共同研究グループでは、ヒトの歯垢(しこう)バイオフィルム[5]から精製された細菌膜小胞に対しても同様の解析を行い、ヒト口腔細菌叢の細菌膜小胞において検出されるDNAについても網羅的な解析を実施しました(図4A)。その結果、口腔内に存在する細菌の中でも存在量が少ないマイナーな細菌種に由来するDNAが細菌膜小胞中から多く検出されました(図4B)。この結果は、口腔細菌の中でも一部の細菌が膜小胞を活発に産生している、もしくはDNAを内包させるメカニズムを保持する可能性を示唆しています。さらに、これらの内包遺伝子の機能を詳細に解析したところ、細菌の病原性に関わるリポ多糖合成遺伝子クラスターが全体の15%程度に内包されていることを明らかにしました(図4C)。先行研究から、リポ多糖合成遺伝子クラスターは遺伝子水平伝播が活発に起こるゲノム領域であると報告されており、また、細菌の病原性そのものを左右する遺伝子でもあるため、細菌膜小胞が遺伝子水平伝播を介して宿主免疫系を介した相互作用を制御する重要な因子であることを強く示唆する結果と考えられます。
図4 歯垢バイオフィルムサンプル由来の細菌膜小胞に対するDNA解析の一例
ヒトの歯垢バイオフィルムから精製された細菌膜小胞に対してドロップレットを用いたDNAシーケンシングを実施した。得られたDNA配列を遺伝子の単位(CDS)ごとに分け、それぞれのCDSを大規模な細菌ゲノムデータベースと照合する(相同性検索を行う)ことで、各CDSの帰属(どの細菌種に由来するか)を調べた。CDSの帰属情報を基にしてそれぞれの細菌膜小胞の由来(産生菌株)を同定し、その菌株に該当するゲノム配列に対してシーケンスリード(塩基配列の断片)をマッピングさせた。これらの一連の解析ステップをつないで自動化させることで、数百個の細菌膜小胞における検出DNA領域を抽出した(A)。CDSの帰属を調べてドロップレットごとにプロットしたところ、細菌叢の解析では検出されなかったマイナーな細菌グループ(Alcaligenesなど)に由来するDNAを多数検出した(B)。さらに、最も高頻度に検出されたAlcaligenes由来の細菌膜小胞DNAを詳細に解析したところ、この細菌のゲノム領域の中でもリポ多糖合成に関わる遺伝子クラスターが顕著に高く検出されることを明らかにした(C)。
- 注)Biller SJ, McDaniel LD, Breitbart M et al. Membrane vesicles in sea water: Heterogeneous DNA content and implications for viral abundance estimates. ISME J 2017;11:394-404. 10.1038/ismej.2016.134
今後の期待
これまで、細菌膜小胞が細菌間での遺伝子水平伝播を引き起こすことで、進化的に重要な役割を果たし得ることが提唱されてきましたが、具体的にどのような機能を持った遺伝子が細菌膜小胞の中に多く存在するのか、ヒト体内といった実環境中に存在する細菌膜小胞のうち、どれくらいの割合の細菌膜小胞が機能的に重要な遺伝子を保持しているかは明らかになっていませんでした。本研究で確立したアプローチは、従来法に比べ極めて高い感度と解像度での解析を実現することで、個々の細菌膜小胞に含まれる遺伝子を、ゲノム全域にわたって解析することが可能となりました。今後こうしたアプローチをさまざまな環境由来の細菌膜小胞に適用することで、これまで見つかっていなかった未知の水平伝播遺伝子やメカニズムの解明につながることが期待されます。
また、今回の研究から、細菌膜小胞の産生経路によって内包される遺伝子領域が変化することが明らかとなったため、細菌膜小胞内部のDNA配列を指標として、特定の病原菌の生理状態を調べる技術への利用も期待できます。共同研究グループではそうした特徴的な遺伝子配列を定量PCRといったより簡便な方法で検出することにも成功しており(図2)、特定の疾患を対象とした新しいバイオマーカーとしての活用にも期待できます。
また、細菌膜小胞内部で見つかった遺伝子の中にはヒトへの病原性に直接的に関わるものも存在しました。将来的にはこうした細菌膜小胞を利用することで、ヒト細菌叢の免疫原性(免疫反応を引き起こす能力)を制御できる可能性も秘めており、疾患治療への応用可能性についても期待できます。
補足説明
- 1.細菌膜小胞別名、メンブレンベシクル(MV)。多様な細菌から分泌される直径50~200nm程度の小さな球状構造体。細胞膜からの出芽(Blebbing)や細胞死に伴って形成され、産生菌由来のタンパク質や核酸、代謝物を含んでいる。細胞間の遺伝子伝達を行う遺伝子カプセルとしての役割や毒素の運搬などに利用され、病原性の発揮にも関与する。近年では、ワクチン開発やドラッグデリバリーシステムへの応用研究も進められている。
- 2.遺伝子水平伝播遺伝子が親から子へと受け渡される垂直伝播とは異なり、同時的に存在する生物間で遺伝情報をやり取りする仕組み。主に細菌で見られ、代表的なメカニズムとして、形質転換(DNAの直接的な取り込み)、形質導入(ファージを介した伝達)、接合(性繊毛を介した伝達)が挙げられる。進化や多様性の創出に重要な仕組みであり、主な例の一つに、抗生物質耐性遺伝子の拡散があり、医療や公衆衛生の面で重要課題となっている。
- 3.膜小胞ヒトを含むさまざまな生き物の細胞膜から産生される100nm程度の構造体であり、細胞間の情報伝達、物質輸送、病原性に関わる機能を備え、ヒト体内にも広く存在することから創薬や疾患診断の観点からも注目を集めている。
- 4.CRISPR-Cas遺伝子クラスター遺伝子クラスターとは、同じ機能や関連する機能を持つ複数の遺伝子が、ゲノム上で物理的に近接してまとまって存在している集まりのこと。CRISPR-Cas遺伝子クラスターは細菌が自身に感染するウイルス(ファージ)から身を守るための免疫システムとしての機能を持ち、主に細菌の獲得免疫システムを担う遺伝子群。CRISPR領域には、ウイルス(ファージ)や可動性遺伝因子由来のDNA断片(スペーサー)が保存されている。Casタンパク質はこの情報を利用し、対応する外来核酸を認識・切断し、感染防御を行う。近年、この原理を応用したゲノム編集技術(CRISPR-Cas9など)が広く用いられている。
- 5.バイオフィルム微生物が固体表面に付着して増殖し、微生物自身が分泌する多糖によって形成される集合体。単独の浮遊細胞と比べて、環境ストレスに対して強い耐性を示す。自然界では河川の岩場やヒト口腔内などに広く存在し、医療現場では医療器具感染の原因としても知られる。
共同研究グループ
理化学研究所 バイオリソース研究センター 統合情報開発室 開発研究員 高野 壮太朗(タカノ・ソウタロウ)
物質・材料研究機構 高分子・バイオ材料研究センター グループリーダー 岡本 章玄(オカモト・アキヒロ) NIMSポスドク研究員 武縄 聡(タケナワ・サトシ) NIMSポスドク研究員 ディビア・ナラダス(Divya Naradasu) 研究業務員 イエン・コウビン(YAN Kangmin) 研究業務員 前原 智子(マエハラ・トモコ)
NIMSジュニア ウェン・シンシン(WEN Xinxin)



